Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
Помню когда был студентом, учили что при взаимодействии Al(OH)3 и ледяной уксусной кислоты получается оксоацетат алюминия состава
[Al3O(CH3COO)6](CH3COO)
Ни в каких учебниках, в иностранных (коттон-вилкинсон, хаускрофт и т.п.), в инете, никгде больше не могу найти упомянания этого загадочного комплекса. И у меня возник вопрос, это соединение вообще есть, или это додумки наших бывших преподавателей и потом может оказалость что это другое вещество? Кто-нибудь может сказать что-то по этому поводу? (кидайте ссылку на статьи если найдете что)
[Al3O(CH3COO)6](CH3COO)
Ни в каких учебниках, в иностранных (коттон-вилкинсон, хаускрофт и т.п.), в инете, никгде больше не могу найти упомянания этого загадочного комплекса. И у меня возник вопрос, это соединение вообще есть, или это додумки наших бывших преподавателей и потом может оказалость что это другое вещество? Кто-нибудь может сказать что-то по этому поводу? (кидайте ссылку на статьи если найдете что)
Re: Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
Скорее предполагают. На основе аналогий с трехвалентными ионами других металлов
45, 7962–7967 (2006).

Houston, J. R., Richens, D. T. & Casey, W. H. Distinct water-exchange mechanisms for similar trinuclear transition-metal clusters. Inorg. Chem.википед писал(а):NMR investigations of the aqueous aluminium(III) / acetate system show the presence of aluminium as a hexaaqua complex, [Al(H2O)6]3+, mononuclear species with different substitutions, and also demonstrate that a significant solution-phase species is an Al13 tridecamer, a moiety reported in conflicting mechanisms of hydrolysis and polymerisation aluminium solutions. Other trivalent metal cations are known to form polynuclear species: iron(III) acetate, for example, forms a trinuclear structure with a triply-bridged oxo centre with a cation [Fe3(μ3–O)(OAc)6(H2O)3]+. The chromium(III) equivalent is isostructural and a mixed hydroxide / acetate compound chromium acetate hydroxide, Cr3(OH)2(OAc)7, has been described. Analogous ruthenium(III), vanadium(III), rhodium(III), and iridium(III) compounds with trinuclear structures are known. Copper(II) acetate and chromium(II) acetate both have dinuclear dihydrate structures, M2(OAc)4(H2O)2, as does rhodium(II) acetate; each shows significant metal-metal bonding interactions.
45, 7962–7967 (2006).

Re: Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
В некоторых русскоязычных изданиях есть, в учебнике Третьякова и в справочных таблицах Туровой, например.
Можно погуглить по оксо- и гидроксоацетатам, возможно в статьях найдётся и исследование структуры.
В качестве основного ацетата алюминия часто упоминается вещество состава Al(OH)(CH3COO)2*H2O, которое даже выпускается промышленно.
Можно погуглить по оксо- и гидроксоацетатам, возможно в статьях найдётся и исследование структуры.
В качестве основного ацетата алюминия часто упоминается вещество состава Al(OH)(CH3COO)2*H2O, которое даже выпускается промышленно.
Бог на стороне не больших батальонов, а тех, кто лучше стреляет (приписывается Вольтеру)
Re: Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
Большое спасибо за ссылку. Я нашел что трифторацетатный комплекс алюминия известен, но не с обычным ацетатом. Просто странно, вспоминая университетский материал, помню уверенно говорилось что оксоацетатный компекс бериллия возгоняется, а алюминия нет, как будто известны свойства комплекса, а потом выясняется что струкрута только предполагаема и это вводит в заблуждение. Даже в контрольных в цепочках есть реакции образования этого комплекса. Может он был получен в советском союзе и не опубликован в доступной литературе..
Re: Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
P.Lemoine, A.Bekaert, J.D.Brion, B.Viossat, Zeitschrift fur Kristallographie - New Crystal Structures, 2006, 221, 309, DOI: 10.1524/ncrs.2006.0087
(μ3-Oxo)-hexakis(μ2-acetato-O,O')-tris(acetonitrile-N)-tri-aluminium(iii) tetrachloroaluminate
(μ3-Oxo)-hexakis(μ2-acetato-O,O')-tris(acetonitrile-N)-tri-aluminium(iii) tetrachloroaluminate
Re: Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
В общем перерыв весь интернет, нашел что растворением гидроксида алюминия в ледяной уксусной кислоте получают основной диацетат Al(OH)(CH3COO)2 - очень старая и известная реакция, а вовсе никакой не оксоацетатный комплекс [Al3O(CH3COO)6](CH3COO), который вообще неизвестен
- Droog_Andrey
- Сообщения: 2671
- Зарегистрирован: Сб сен 29, 2007 8:29 pm
- Контактная информация:
Re: Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
У катиона алюминия слишком большая поляризующая способность, чтобы вот такой трёхкоординированный кислород получился.
2^74207281-1 is prime!
Re: Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
Да запросто. Такой обобщённый карбоксилатный мотив очень известен в среде тех, кто занимается пористыми координационными полимерами (в криворечии MOFs). См. например MIL100(Al), NH2-MIL101(Al) (тримезат и аминотерефталат алюминия).Droog_Andrey писал(а): ↑Вс янв 29, 2017 10:39 pmУ катиона алюминия слишком большая поляризующая способность, чтобы вот такой трёхкоординированный кислород получился.
- Droog_Andrey
- Сообщения: 2671
- Зарегистрирован: Сб сен 29, 2007 8:29 pm
- Контактная информация:
Re: Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
Гм, и правда:
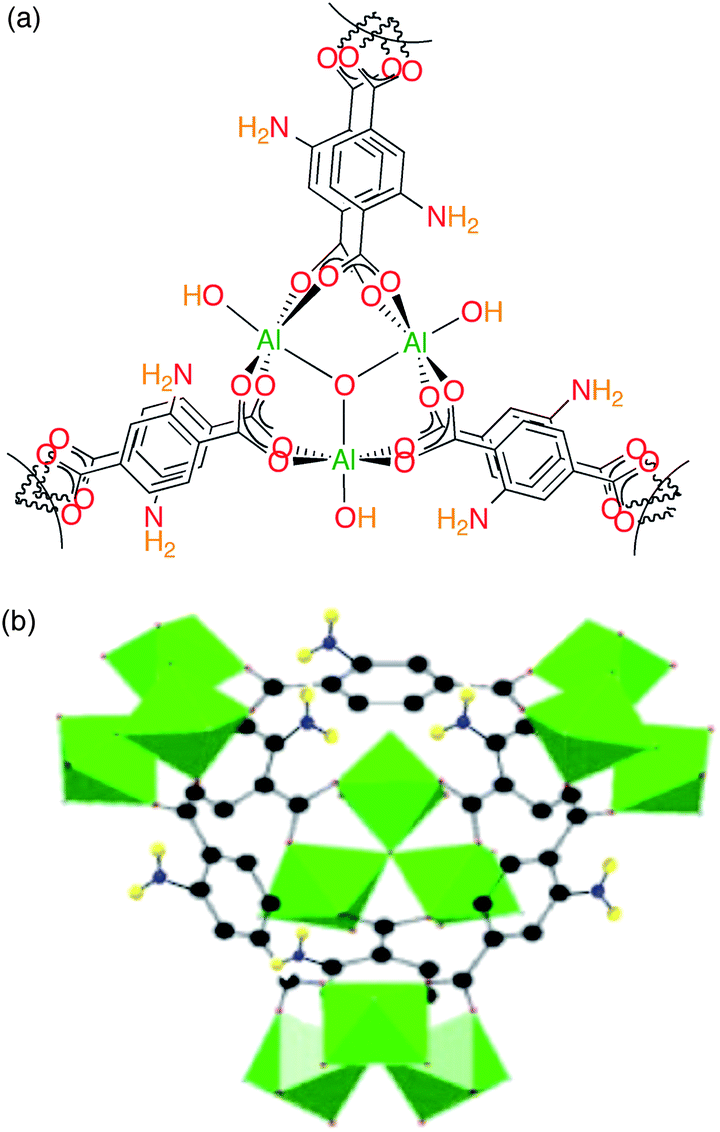
Хотя тут в какой-то степени помогает параллельно укладывающаяся ароматика.

Хотя тут в какой-то степени помогает параллельно укладывающаяся ароматика.
2^74207281-1 is prime!
Re: Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
Рисунок там немного кривой - на алюминиях не все терминальные лиганды OH, a (OH-1/3, H2O-2/3). Иными словами кластер там локально электронейтральный, по-крайней мере так считается. В остальном - ОКDroog_Andrey писал(а): ↑Пн янв 30, 2017 12:51 amГм, и правда:
...
Хотя тут в какой-то степени помогает параллельно укладывающаяся ароматика.
Органика там ни разу не укладывается параллельно, никакого стекинга там нет. Там 3D структуры, например в изображённом выше NH2-MIL-101(Al) топология такая же как в MTN цеолите. Но да, сама полимерность вместе с жёсткостью каркаса может делу немного подсоблять. Ведь это достаточно стойкие типы - они есть ещё как минимум для трёхвалентных Cr, Fe и V.
Re: Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
Таки есть!
Нашлось упоминание в уважаемом издании Wilkinson G. (ed.) Comprehensive Coordination Chemistry. Vol 3. p.117 Ссылка ведёт на книгу R.C. Mehrotra, R. Bohra Metal Carboxylates, Academic Press, 1983, которая в электронном виде, увы, недоступна.
У вас нет необходимых прав для просмотра вложений в этом сообщении.
Бог на стороне не больших батальонов, а тех, кто лучше стреляет (приписывается Вольтеру)
-
Dambrovsky
- Сообщения: 67
- Зарегистрирован: Вс апр 09, 2017 2:46 pm
Re: Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
Доброго дня,
Хотел вставить свои ржавые две копейки по теме координации в вышеупомянутой молекуле, одно время занимались алкоксилатами металлов кремния, циркония, иттрия и других, в том числе алюминия. После синтеза делали разгонку в вакууме.
В общем все перегоняются как положено, даже можно корреляцию делать в координатах мол.масса орг.радикала—температура кипения в пределах одного металла. У АЛЮМИНИЯ это не работает. Вы сравните температуры кипения метоксисилана-этоксисилана-изопропроксисилана-бутоксисилана. И этот же ряд в ряду производные алюминия. Окажется что метоксид и этоксид алюминия перегоняются выше чем изопропоксид, если конечно сможете вообще их перегнать (шибко высоко кипят), а изопропоксид кипит почти столько же сколько бутоксид алюминия (фактически гонится ассоциат из 4 молекул). И внимание, бутоксид алюминия не кристаллизуется (только не помню кажется вторбутоксид), а метоксид ни в чем не растворяется (ничтожно на ямр его растворяют, но не количественно), просто кирпич. Это широко известно и освещается в литературе в том числе и Метрохрой на которого тут ссылаются. Все по-разному обьясняют, а на самом деле толком сказать ничего не могут... мы не разбирались, но проверили что гонится именно мономер, а не частично гидролизованный тетрамер. Представить как перегоняется 4 молекулы мономера изопропилата алюминия как одно целое это почти так же как и вода, с мол. массой 18, а кипит 100 град., правда причина разная. Очевидно что причина такого ненормального поведения в ассоциации алюминий-кислород.
То что Вам сказали это правда, почему это происходит, до конца сам не понимаю.
Хотел вставить свои ржавые две копейки по теме координации в вышеупомянутой молекуле, одно время занимались алкоксилатами металлов кремния, циркония, иттрия и других, в том числе алюминия. После синтеза делали разгонку в вакууме.
В общем все перегоняются как положено, даже можно корреляцию делать в координатах мол.масса орг.радикала—температура кипения в пределах одного металла. У АЛЮМИНИЯ это не работает. Вы сравните температуры кипения метоксисилана-этоксисилана-изопропроксисилана-бутоксисилана. И этот же ряд в ряду производные алюминия. Окажется что метоксид и этоксид алюминия перегоняются выше чем изопропоксид, если конечно сможете вообще их перегнать (шибко высоко кипят), а изопропоксид кипит почти столько же сколько бутоксид алюминия (фактически гонится ассоциат из 4 молекул). И внимание, бутоксид алюминия не кристаллизуется (только не помню кажется вторбутоксид), а метоксид ни в чем не растворяется (ничтожно на ямр его растворяют, но не количественно), просто кирпич. Это широко известно и освещается в литературе в том числе и Метрохрой на которого тут ссылаются. Все по-разному обьясняют, а на самом деле толком сказать ничего не могут... мы не разбирались, но проверили что гонится именно мономер, а не частично гидролизованный тетрамер. Представить как перегоняется 4 молекулы мономера изопропилата алюминия как одно целое это почти так же как и вода, с мол. массой 18, а кипит 100 град., правда причина разная. Очевидно что причина такого ненормального поведения в ассоциации алюминий-кислород.
То что Вам сказали это правда, почему это происходит, до конца сам не понимаю.
"делай добро и бросай его в воду, добро не пропадет" ТуманЯн
Re: Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
amik, спасибо за ссылку-картинку, значит есть соединение, просто хорошо затерялось в прошлом...
если когда либо будет доступ к физической книге, почитаю
если когда либо будет доступ к физической книге, почитаю
- Droog_Andrey
- Сообщения: 2671
- Зарегистрирован: Сб сен 29, 2007 8:29 pm
- Контактная информация:
Re: Существует ли на самом деле [Al3O(CH3COO)6](CH3COO)
Первое упоминание: 10.1007/BF01502711
Первые сомнения: 10.1016/0022-1902(60)80303-X
Первый синтез с трифторацетатом: 10.1021/ic010880y
С ацетатом: 10.1524/ncrs.2006.0087
Обзор: 10.1016/B978-0-08-102688-5.00062-3
Первые сомнения: 10.1016/0022-1902(60)80303-X
Первый синтез с трифторацетатом: 10.1021/ic010880y
С ацетатом: 10.1524/ncrs.2006.0087
Обзор: 10.1016/B978-0-08-102688-5.00062-3
2^74207281-1 is prime!
Кто сейчас на конференции
Сейчас этот форум просматривают: нет зарегистрированных пользователей и 0 гостей